Обеззараживание воды раствором гипохлорита натрия 0.8%
Свод правил (СП 31.13330.2012. Водоснабжение. Наружные сети и сооружения.) строго регламентирует методы обеззараживания воды.
Первыми в списке из допускаемых методов обеззараживания воды хлорсодержащими реагентами установлены:
хлорирование с применением жидкого хлора, растворов гипохлорита натрия, сухих реагентов или прямым электролизом.
Использование жидкого хлора следует предусматривать на объектах при расходе хлора не менее 40 кг/сутки.
Электролитическое приготовление гипохлорита натрия следует предусматривать из раствора поваренной соли или естественных минерализованных вод с содержанием хлоридов не менее 40 г/л на водоочистных станциях с расходом активного хлора до 80 кг/сутки.
Использование товарного гипохлорита натрия целесообразно на объектах, расположенных не более 250-300 км от завода-поставщика.
Для приготовления растворов из сухих хлорреагентов необходимо предусматривать расходные баки (не менее двух) общей вместимостью, определяемой из концентрации раствора 1-2% и одной заготовки в сутки. Баки должны оборудоваться мешалками. Для дозирования следует применять раствор, отстоянный не менее 12 часов. Следует предусматривать периодическое удаление осадка из баков и дозаторов.
В соответствии с СНиП 2.04.02-84 обеззараживание воды прямым электролизом следует применять при содержании хлоридов не менее 20 мг/л и жесткости не более 7 мг-экв/л на станциях производительностью до 5000 м³/сутки.
В соответствии с МДК 3-02.2001 обеззараживание воды прямым электролизом следует применять при содержании хлоридов не менее 30 мг/л и жесткости не более 5 мг-экв/л.
В соответствии с СП 31.13330.2012 обеззараживание воды прямым электролизом следует применять при содержании хлоридов не менее 40 мг/л и жесткости воды не более 7 мг-экв/л на станциях производительностью до 5000 м³/сутки.
Для предотвращения образования хлорфенольного запаха или увеличения пролонгирующего действия хлора при длительном хранении и транспортировке питьевой воды необходимо предусмотреть её аммонизацию.
Продолжительность контакта хлора с водой от момента смешения до поступления воды к ближайшему потребителю следует принимать в соответствии с СанПиН 2.1.4.1074.
Во всех случаях введения хлорреагентов в воду происходит их диссоциация с образованием «активного хлора».
Вещества, объединённые понятием «активный хлор», подразделяют на две группы:
«свободный активный хлор» – это сильные окислители Cl2, HClO и ClOˉ,
«связанный активный хлор» – это относительно слабые окислители NH2Cl, NHCl2 и NCl3.
«Свободный активный хлор» понимают, как суммарное содержание Cl2 + HClO + ClOˉ.
Содержание каждого из этих веществ в отдельности зависит от рН раствора и констант равновесия.
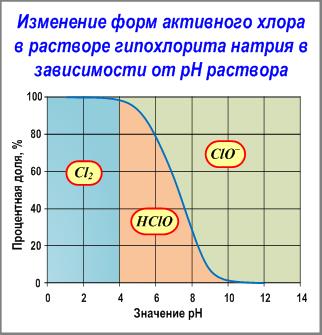

В практике применения гипохлоритов для окисления и/или обеззараживания природных вод с рН в диапазоне 6-9 в «свободном активном хлоре» молекулярный хлор Cl2 отсутствует, а содержатся хлорноватистая кислота HClO и гипохлорит-иона ClOˉ.
Непосредственно в растворах гипохлоритов с рН более 9 преобладает содержание ClOˉ.
Хлорноватистая кислота HClO и гипохлорит-иона ClOˉ являются кислородными соединениями хлора.
Окислительные процессы кислородных соединений хлора обусловлены действием атомарного кислорода, образующимся в результате разложения «активного хлора» при взаимодействии с восстановителями (в качестве восстановителей могут выступать катионы металлов – Mn2+, Fe2+ и др.):
НСlО → НСl + О*.
Во многих случаях процесс окисления происходит с разложением «активного хлора» на атомарный кислород и хлорид-ион. Атомарный кислород участвует в окислительном процессе, а ион Сlˉ остается в растворе в виде хлоридов.











